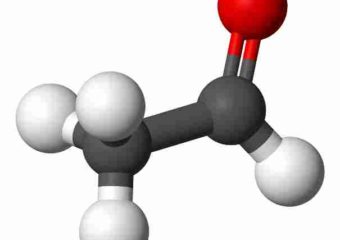
Acide acétique
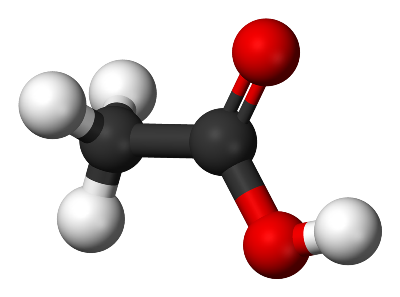
L’acide acétique , également appelé acide éthanoïque , est un composé chimique organique principalement connu pour donner au vinaigre son goût acide et son odeur piquante. C’est l’un des acides carboxyliques les plus simples (le deuxième après l’acide formique ) et sa formule chimique est CH3COOH . À l’état pur et anhydre , appelé acide acétique glacial, c’est un liquide incolore et hygroscopique qui gèle en dessous de 16,7 °C (62 °F ) pour former un solide cristallin incolore . Il est corrosif et ses vapeurs irritent les yeux, provoquent une sensation de brûlure nasale et peuvent provoquer des maux de gorge et une congestion pulmonaire. Le terme acétate est utilisé pour désigner l’anion carboxylate (CH3COO- ) ou l’un des sels ou esters de l’acide acétique.
Cet acide est un réactif chimique important et un produit chimique industriel utile à la production de diverses fibres synthétiques et autres matériaux polymères . Ces polymères comprennent le polyéthylène téréphtalate, utilisé principalement dans les bouteilles de boissons gazeuses ; l’acétate de cellulose , principalement utilisé pour les films photographiques ; et l’acétate de polyvinyle, utilisé pour la colle à bois . Dans les ménages, l’acide acétique dilué est souvent utilisé dans les détartrants. L’ industrie agroalimentaire l’utilise (sous le code d’additif alimentaire E260) comme correcteur d’acidité.
La demande mondiale d’acide acétique est estimée à environ 6,5 millions de tonnes par an (Mt/an). Sur cette quantité, environ 1,5 Mt/an est satisfaite par le recyclage ; le reste est fabriqué à partir de matières premières pétrochimiques ou de sources biologiques.
Nomenclature
Le nom trivial « acide acétique » est le nom le plus couramment utilisé et officiellement privilégié par l’Union internationale de chimie pure et appliquée (UICPA). Ce nom dérive du latin « acetum », qui signifie vinaigre. Le synonyme « acide éthanoïque » est un nom systématique parfois utilisé dans les introductions à la nomenclature chimique.
L’acide acétique glacial est un nom courant pour l’acide acétique anhydre. Similaire au nom allemand Eisessig (littéralement « vinaigre de glace »), ce nom vient des cristaux semblables à de la glace qui se forment légèrement en dessous de la température ambiante, soit 16,7 °C (environ 62 °F).
L’abréviation la plus courante et officielle de l’acide acétique est AcOH ou HOAc , où Ac représente le groupe acétyle CH₃₃C (=O)₃. Dans le contexte des réactions acido-basiques, l’ abréviation HAc est souvent utilisée, Ac représentant l’ anion acétate (CH₃COO₃ ) , bien que cette utilisation soit considérée par beaucoup comme trompeuse. Dans les deux cas, l’ ac ne doit pas être confondu avec l’abréviation de l’ élément chimique actinium.
L’ acide acétique a pour formule brute CH₂O et pour formule moléculaire C₂H₄O₂ . Cette dernière est souvent écrite CH₃ – COOH, CH₃COOH ou CH₃CO₂H pour mieux refléter sa structure. L’ ion résultant de la perte de H₃ de l’ acide acétique est l’ anion acétate . Le nom acétate peut également désigner un sel contenant cet anion ou un ester de l’acide acétique.
Histoire
Le vinaigre est aussi vieux que la civilisation elle-même, peut-être même plus vieux. Les bactéries productrices d’acide acétique sont présentes partout dans le monde, et toute culture pratiquant le brassage de la bière ou du vin a inévitablement découvert le vinaigre, résultat naturel de l’exposition de ces boissons alcoolisées à l’air.
L’utilisation de l’acide acétique en chimie remonte à l’Antiquité. Au IIIe siècle avant J.-C. , le philosophe grec Théophraste a décrit l’action du vinaigre sur les métaux pour produire des pigments utiles en art, notamment le blanc de plomb (carbonate de plomb) et le vert-de-gris, un mélange vert de sels de cuivre dont l’acétate de cuivre(II). Les Romains de l’Antiquité faisaient bouillir du vin aigre dans des marmites en plomb pour produire un sirop très sucré appelé sapa. Le sapa était riche en acétate de plomb, une substance sucrée également appelée sucre de plomb ou sucre de Saturne , qui contribua au saturnisme au sein de l’aristocratie romaine. L’alchimiste persan du VIIIe siècle, Jabir Ibn Hayyan (Geber), concentra l’acide acétique du vinaigre par distillation .
À la Renaissance , l’acide acétique glacial était préparé par distillation sèche d’acétates métalliques. L’ alchimiste allemand du XVIe siècle , Andreas Libavius, décrivit ce procédé et compara l’acide acétique glacial ainsi obtenu au vinaigre. La présence d’eau dans le vinaigre a un effet si profond sur les propriétés de l’acide acétique que, pendant des siècles, de nombreux chimistes ont cru que l’acide acétique glacial et l’acide du vinaigre étaient deux substances différentes. Le chimiste français Pierre Adet démontra leur identité.
En 1847, le chimiste allemand Hermann Kolbe synthétisa pour la première fois de l’acide acétique à partir de matières inorganiques . Cette réaction comprenait la chloration du disulfure de carbone en tétrachlorure de carbone, suivie d’une pyrolyse en tétrachloroéthylène et d’une chloration aqueuse en acide trichloroacétique, pour aboutir à une réduction électrolytique en acide acétique.
En 1910, la majeure partie de l’acide acétique glacial était obtenue à partir de la « liqueur pyroligneuse » issue de la distillation du bois. L’acide acétique en était isolé par traitement au lait de chaux, puis l’acétate de calcium obtenu était acidifié à l’acide sulfurique pour récupérer l’acide acétique. À cette époque, l’Allemagne produisait 10 000 tonnes d’acide acétique glacial, dont environ 30 % servaient à la fabrication de la teinture indigo.
Propriétés chimiques
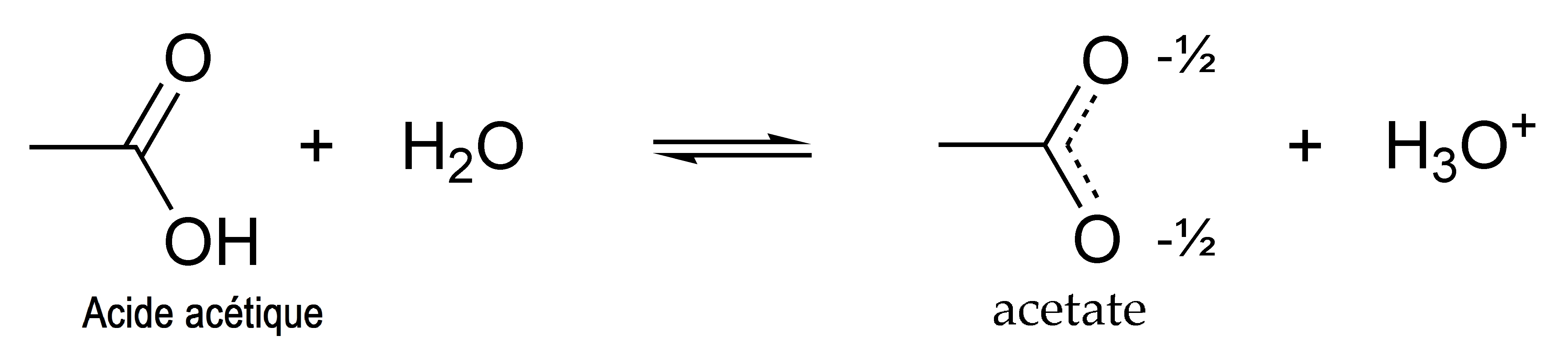
Acidité
L’atome d’hydrogène (H) du groupe carboxyle (−COOH) des acides carboxyliques tels que l’acide acétique peut être libéré sous forme d’ion H + ( proton ), ce qui leur confère leur caractère acide. L’acide acétique est un acide faible, effectivement monoprotique en solution aqueuse, avec un pKa de 4,8. Sa base conjuguée est l’acétate (CH3COO− ) . Une solution 1,0 M (environ la concentration du vinaigre domestique) a un pH de 2,4, ce qui indique que seulement 0,4 % des molécules d’acide acétique sont dissociées.
Dimère cyclique
Dimère cyclique de l’acide acétique ; les lignes pointillées représentent les liaisons hydrogène.
Français La structure cristalline de l’acide acétique montre que les molécules s’apparient en dimères reliés par des liaisons hydrogène . Les dimères peuvent également être détectés dans la vapeur à 120 °C. Ils sont également présents en phase liquide dans des solutions diluées dans des solvants sans liaison hydrogène, et dans une certaine mesure dans l’acide acétique pur, mais sont perturbés par les solvants à liaison hydrogène. L’enthalpie de dissociation du dimère est estimée à 65,0–66,0 kJ/mol, et l’entropie de dissociation à 154–157 J mol –1 K –1 . Ce comportement de dimérisation est partagé par d’autres acides carboxyliques inférieurs.
Solvant
L’acide acétique liquide est un solvant protique hydrophile (polaire), similaire à l’éthanol et à l’eau . Avec une constante diélectrique modérée de 6,2, il peut dissoudre non seulement les composés polaires tels que les sels inorganiques et les sucres , mais aussi les composés apolaires tels que les huiles et des éléments comme le soufre et l’iode . Il se mélange facilement à de nombreux autres solvants polaires et apolaires tels que l’eau, le chloroforme et l’hexane. Cette propriété de dissolution et sa miscibilité en font un produit chimique industriel largement utilisé.
Réactions chimiques
L’acide acétique est corrosif pour de nombreux métaux, dont le fer , le magnésium et le zinc , formant de l’ hydrogène gazeux et des sels métalliques appelés acétates. L’aluminium , exposé à l’oxygène, forme à sa surface une fine couche d’oxyde d’aluminium relativement résistante, ce qui permet d’utiliser des réservoirs en aluminium pour transporter l’acide acétique. Les acétates métalliques peuvent également être préparés à partir d’acide acétique et d’une base appropriée , comme dans la réaction populaire « bicarbonate de soude + vinaigre ». À l’exception notable de l’acétate de chrome(II), presque tous les acétates sont solubles dans l’eau.
Mg ( s ) + 2 CH 3 COOH(aq) → (CH 3 COO) 2 Mg(aq) + H 2 ( g )
NaHCO 3 (s) + CH 3 COOH(aq) → CH 3 COONa (aq) + CO 2 (g) + H 2 O ( l )
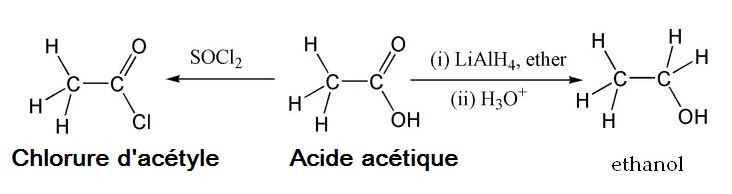
L’acide acétique subit les réactions chimiques typiques d’un acide carboxylique : il produit notamment de l’acide éthanoïque en réaction avec des alcalis, un éthanoate métallique en réaction avec un métal, et un éthanoate métallique, de l’eau et du dioxyde de carbone en réaction avec des carbonates et des hydrogénocarbonates. Parmi ses réactions les plus notables, on trouve la formation d’ éthanol par réduction et la formation de dérivés tels que le chlorure d’acétyle par substitution nucléophile d’acyle. Parmi les autres dérivés de substitution, on trouve l’anhydride acétique, produit par perte d’eau de deux molécules d’acide acétique. Des esters d’acide acétique peuvent également être formés par estérification de Fischer, ainsi que des amides . Chauffé à plus de 440 °C, l’acide acétique se décompose pour produire du dioxyde de carbone et du méthane , ou du cétène et de l’eau.
Détection
L’acide acétique est détectable par son odeur caractéristique. Une réaction colorée des sels d’acide acétique est la solution de chlorure de fer (III), qui produit une couleur rouge foncé qui disparaît après acidification. Les acétates, chauffés avec du trioxyde d’arsenic, forment de l’oxyde de cacodyle, détectable par ses vapeurs malodorantes.
Biochimie
Le groupe acétyle , dérivé de l’acide acétique, est fondamental pour la biochimie de pratiquement toutes les formes de vie. Lié à la coenzyme A, il est essentiel au métabolisme des glucides et des lipides . Cependant, la concentration d’acide acétique libre dans les cellules est maintenue à un faible niveau afin de ne pas perturber le pH du contenu cellulaire. Contrairement à certains acides carboxyliques à chaîne longue (les acides gras ), l’acide acétique n’est pas présent dans les triglycérides naturels. Cependant, la triacétine (triacétate de glycérine), un triglycéride artificiel, est un additif alimentaire courant, présent dans les cosmétiques et les médicaments topiques.
L’acide acétique est produit et excrété par certaines bactéries , notamment celles du genre Acetobacter et Clostridium acetobutylicum. Ces bactéries sont omniprésentes dans les aliments , l’eau et le sol , et l’acide acétique est produit naturellement lorsque les fruits et certains autres aliments se gâtent. L’acide acétique entre également dans la composition de la lubrification vaginale des humains et d’autres primates , où il semble agir comme un agent antibactérien doux.
Production
L’acide acétique est produit par synthèse et par fermentation bactérienne. Aujourd’hui, la voie biologique ne représente qu’environ 10 % de la production mondiale, mais elle reste importante pour la production de vinaigre, car de nombreuses lois mondiales sur la pureté des aliments stipulent que le vinaigre utilisé dans les aliments doit être d’origine biologique. Environ 75 % de l’acide acétique destiné à l’industrie chimique est obtenu par carbonylation du méthanol, expliquée ci-dessous. Le reste est produit par d’autres méthodes.
Français La production mondiale totale d’acide acétique vierge est estimée à 5 Mt/a (millions de tonnes métriques par an), dont environ la moitié est produite aux États-Unis . La production européenne s’élève à environ 1 Mt/a et est en déclin, et 0,7 Mt/a est produite au Japon . 1,5 Mt supplémentaires sont recyclées chaque année, ce qui porte le marché mondial total à 6,5 Mt/a. Les deux plus grands producteurs d’acide acétique vierge sont Celanese et BP Chemicals . Les autres grands producteurs sont Millennium Chemicals, Sterling Chemicals, Samsung, Eastman et Svensk Etanolkemi.
Carbonylation du méthanol
La majeure partie de l’acide acétique vierge est produite par carbonylation du méthanol. Dans ce procédé, le méthanol et le monoxyde de carbone réagissent pour produire de l’acide acétique selon l’équation chimique suivante :
CH3OH + CO → CH3COOH
Le procédé utilise l’iodométhane comme intermédiaire et se déroule en trois étapes. Un catalyseur , généralement un complexe métallique , est nécessaire pour la carbonylation (étape 2).
(1) CH 3 OH + HI → CH 3 I + H 2 O
(2) CH 3 I + CO → CH 3 COI
(3) CH 3 COI + H 2 O → CH 3 COOH + HI
Français En modifiant les conditions du procédé, l’anhydride acétique peut également être produit dans la même usine. Étant donné que le méthanol et le monoxyde de carbone sont tous deux des matières premières de base, la carbonylation du méthanol est depuis longtemps apparue comme une méthode intéressante pour la production d’acide acétique. Henry Drefyus de British Celanese a développé une usine pilote de carbonylation du méthanol dès 1925. Cependant, le manque de matériaux pratiques capables de contenir le mélange réactionnel corrosif aux pressions élevées requises (200 atm ou plus) a découragé la commercialisation de ces voies pendant un certain temps. Le premier procédé commercial de carbonylation du méthanol, qui utilisait un catalyseur au cobalt , a été développé par la société chimique allemande BASF en 1963. En 1968, un catalyseur à base de rhodium ( cis −[Rh(CO) 2 I 2 ] − ) a été découvert, qui pouvait fonctionner efficacement à basse pression avec presque aucun sous-produit. Français La première usine utilisant ce catalyseur a été construite par l’entreprise chimique américaine Monsanto en 1970, et la carbonylation du méthanol catalysée par le rhodium est devenue la méthode dominante de production d’acide acétique (voir procédé Monsanto). À la fin des années 1990, l’entreprise chimique BP Chemicals a commercialisé le catalyseur Cativa ([Ir(CO) 2 I 2 ] − ), qui est promu par le ruthénium . Ce procédé catalysé par l’iridium est plus écologique et plus efficace et a largement supplanté le procédé Monsanto, souvent dans les mêmes usines de production.
Oxydation de l’acétaldéhyde
Avant la commercialisation du procédé Monsanto, la majeure partie de l’acide acétique était produite par oxydation de l’acétaldéhyde . Cette méthode de fabrication reste la deuxième plus importante, bien qu’elle ne soit pas compétitive par rapport à la carbonylation du méthanol. L’acétaldéhyde peut être produit par oxydation du butane ou du naphta léger, ou par hydratation de l’éthylène.
Lorsque le butane ou le naphta léger est chauffé avec de l’air en présence de divers ions métalliques , notamment ceux du manganèse , du cobalt et du chrome , des peroxydes se forment puis se décomposent pour produire de l’acide acétique selon l’ équation chimique
2 C 4 H 10 + 5 O 2 → 4 CH 3 COOH + 2 H 2 O
Généralement, la réaction est réalisée à une température et une pression aussi élevées que possible tout en maintenant le butane liquide. Les conditions de réaction typiques sont 150 °C et 55 atm. Plusieurs sous-produits peuvent également se former, notamment la butanone, l’acétate d’éthyle , l’acide formique et l’acide propionique. Ces sous-produits ont également une valeur commerciale, et les conditions de réaction peuvent être modifiées pour en produire davantage si cela s’avère économiquement rentable. Cependant, la séparation de l’acide acétique de ces sous-produits augmente le coût du procédé.
Dans des conditions similaires et en utilisant des catalyseurs similaires à ceux utilisés pour l’oxydation du butane, l’acétaldéhyde peut être oxydé par l’ oxygène de l’air pour produire de l’acide acétique.
2 CH 3 CHO + O 2 → 2 CH 3 COOH
Grâce à des catalyseurs modernes, cette réaction peut atteindre un rendement en acide acétique supérieur à 95 %. Les principaux sous-produits sont l’acétate d’éthyle , l’acide formique et le formaldéhyde , tous ayant des points d’ébullition inférieurs à ceux de l’acide acétique et facilement séparables par distillation .
Oxydation de l’éthylène
Fermentation
Fermentation oxydative
Pendant la majeure partie de l’histoire de l’humanité, l’acide acétique, sous forme de vinaigre, a été produit par des bactéries du genre Acetobacter. Avec suffisamment d’oxygène, ces bactéries peuvent produire du vinaigre à partir de divers aliments alcoolisés. Parmi les aliments couramment utilisés figurent le cidre de pomme, le vin et les purées de céréales , de malt, de riz ou de pommes de terre fermentés . La réaction chimique globale facilitée par ces bactéries est la suivante :
C2H5OH + O2 → CH3COOH + H2O
Une solution alcoolique diluée inoculée avec Acetobacter et conservée dans un endroit chaud et aéré se transformera en vinaigre en quelques mois. Les méthodes industrielles de fabrication du vinaigre accélèrent ce processus en améliorant l’apport d’ oxygène aux bactéries.
Les premiers lots de vinaigre produits par fermentation sont probablement issus d’erreurs de vinification. Si le moût fermente à une température trop élevée, les acétobactéries envahissent les levures naturellement présentes sur le raisin. Face à la demande croissante de vinaigre à des fins culinaires, médicales et sanitaires, les vignerons ont rapidement appris à utiliser d’autres matières organiques pour produire du vinaigre pendant les chauds mois d’été, avant que les raisins ne soient mûrs et prêts à être vinifiés. Cette méthode était cependant lente et pas toujours efficace, car les vignerons ne maîtrisaient pas le procédé.
L’un des premiers procédés commerciaux modernes fut la « méthode rapide » ou « méthode allemande », pratiquée pour la première fois en Allemagne en 1823. Ce procédé consiste à fermenter dans une tour remplie de copeaux de bois ou de charbon de bois . La matière alcoolisée est versée goutte à goutte au sommet de la tour, tandis que de l’air frais est amené par le bas par convection naturelle ou forcée . L’amélioration de l’apport d’air permet de réduire le temps de préparation du vinaigre de plusieurs mois à quelques semaines.
Aujourd’hui, la plupart des vinaigres sont fabriqués en culture en cuve immergée, décrite pour la première fois en 1949 par Otto Hromatka et Heinrich Ebner. Cette méthode consiste à fermenter l’alcool en vinaigre dans une cuve constamment agitée, et à apporter de l’oxygène par barbotage d’air dans la solution. Grâce à cette méthode, un vinaigre à 15 % d’acide acétique peut être préparé en seulement deux à trois jours.
Fermentation anaérobie
Certaines espèces de bactéries anaérobies, dont plusieurs membres du genre Clostridium, peuvent convertir directement les sucres en acide acétique, sans utiliser d’éthanol comme intermédiaire. La réaction chimique globale réalisée par ces bactéries peut être représentée ainsi :
C6H12O6 → 3CH3COOH
Plus intéressant encore du point de vue d’un chimiste industriel, bon nombre de ces bactéries acétogènes peuvent produire de l’acide acétique à partir de composés à un seul carbone, notamment le méthanol , le monoxyde de carbone ou un mélange de dioxyde de carbone et d’hydrogène :
2 CO 2 + 4 H 2 → CH 3 COOH + 2 H 2 O
Cette capacité des Clostridium à utiliser directement les sucres, ou à produire de l’acide acétique à partir d’intrants moins coûteux, signifie que ces bactéries pourraient potentiellement produire de l’acide acétique plus efficacement que les bactéries oxydant l’éthanol comme Acetobacter. Cependant, les bactéries Clostridium sont moins acido-tolérantes qu’Acetobacter . Même les souches de Clostridium les plus acido-tolérantes peuvent produire du vinaigre contenant seulement quelques pour cent d’acide acétique, alors que certaines souches d’Acetobacter peuvent produire du vinaigre contenant jusqu’à 20 pour cent d’acide acétique. À l’heure actuelle, il reste plus rentable de produire du vinaigre avec Acetobacter qu’avec Clostridium puis de le concentrer. Par conséquent, bien que les bactéries acétogènes soient connues depuis 1940, leur utilisation industrielle reste limitée à quelques applications de niche.
Applications
L’acide acétique est un réactif chimique utilisé dans la production de nombreux composés. Il est principalement utilisé dans la production d’acétate de vinyle monomère, suivi de près par la production d’anhydride acétique et d’esters. Le volume d’acide acétique utilisé dans le vinaigre est relativement faible.
Acétate de vinyle monomère
L’acide acétique est principalement utilisé pour la production d’acétate de vinyle monomère (VAM). Cette application consomme environ 40 à 45 % de la production mondiale d’acide acétique. La réaction se produit entre l’éthylène et l’acide acétique avec de l’oxygène sur un catalyseur au palladium .
2 H3C – COOH + 2 C2H4 + O2 → 2 H3C – CO-O- CH = CH2 + 2 H2O
L’acétate de vinyle peut être polymérisé en acétate de polyvinyle ou en d’autres polymères , qui sont appliqués dans les peintures et les adhésifs .
Anhydride acétique
Le produit de condensation de deux molécules d’acide acétique est l’anhydride acétique. La production mondiale d’anhydride acétique constitue une application majeure et représente environ 25 à 30 % de la production mondiale d’acide acétique. L’anhydride acétique peut être produit directement par carbonylation du méthanol en contournant l’acide, et les usines Cativa peuvent être adaptées à la production d’anhydride.
L’anhydride acétique est un puissant agent d’acétylation. À ce titre, son application principale concerne l’acétate de cellulose , un textile synthétique également utilisé pour les films photographiques. L’anhydride acétique est également un réactif pour la production d’ aspirine , d’héroïne et d’autres composés.
Vinaigre
Sous forme de vinaigre , les solutions d’acide acétique (généralement de 5 à 18 % d’acide acétique, le pourcentage étant généralement calculé en masse) sont utilisées directement comme condiment, ainsi que pour le saumurage des légumes et autres aliments. Le vinaigre de table est généralement plus dilué (5 à 8 % d’acide acétique), tandis que les marinades industrielles utilisent généralement des solutions plus concentrées. La quantité d’acide acétique utilisée sous forme de vinaigre à l’échelle mondiale est faible, mais historiquement, c’est de loin l’application la plus ancienne et la plus connue.
Utiliser comme solvant
L’acide acétique glacial est un excellent solvant protique polaire, comme indiqué précédemment . Il est fréquemment utilisé comme solvant de recristallisation pour purifier les composés organiques. L’acide acétique fondu pur est utilisé comme solvant dans la production d’acide téréphtalique (TPA), la matière première du polyéthylène téréphtalate (PET). Bien qu’il ne représente actuellement que 5 à 10 % de l’utilisation mondiale d’acide acétique, cette application spécifique devrait connaître une croissance significative au cours de la prochaine décennie, avec l’augmentation de la production de PET.
L’acide acétique est souvent utilisé comme solvant pour les réactions impliquant des carbocations, comme l’alkylation de Friedel-Crafts. Par exemple, une étape de la fabrication commerciale du camphre synthétique implique un réarrangement de Wagner-Meerwein du camphène en acétate d’isobornyle ; dans ce cas, l’acide acétique agit à la fois comme solvant et comme nucléophile pour piéger le carbocation réarrangé. L’acide acétique est le solvant de choix pour la réduction d’un groupe aryle nitro en aniline par palladium sur charbon.
L’acide acétique glacial est utilisé en chimie analytique pour l’estimation de substances faiblement alcalines telles que les amides organiques. L’acide acétique glacial est une base beaucoup plus faible que l’eau ; l’amide se comporte donc comme une base forte dans ce milieu. Il peut ensuite être titré à l’aide d’une solution d’un acide très fort, tel que l’acide perchlorique, dans de l’acide acétique glacial.
Autres applications
Des solutions diluées d’acide acétique sont également utilisées pour leur légère acidité. En milieu domestique, on les utilise par exemple dans un bain d’arrêt lors du développement des films photographiques et dans les détartrants pour éliminer le calcaire des robinets et des bouilloires. L’acidité est également utilisée pour traiter les piqûres de méduses-boîtes en désactivant les cellules urticantes, prévenant ainsi des blessures graves, voire mortelles, en cas d’application immédiate. Elle est également utilisée pour traiter les infections de l’oreille externe chez l’homme, dans des préparations comme Vosol. De même, l’acide acétique est utilisé comme conservateur en aérosol pour l’ensilage du bétail, afin de freiner la croissance bactérienne et fongique .
L’acide acétique glacial est également utilisé pour éliminer les verrues. Un anneau de vaseline est appliqué sur la peau autour de la verrue pour empêcher sa propagation, et une à deux gouttes d’acide acétique glacial sont appliquées sur la verrue. Le traitement est répété quotidiennement. Cette méthode est indolore et offre un taux de réussite élevé, contrairement à de nombreux autres traitements. L’absorption d’acide acétique glacial est sans danger en petites quantités.
Plusieurs sels organiques ou inorganiques sont produits à partir de l’acide acétique, notamment :
- Acétate de sodium — utilisé dans l’ industrie textile et comme conservateur alimentaire (E262).
- Acétate de cuivre (II) — utilisé comme pigment et fongicide.
- Acétate d’aluminium et acétate de fer (II) — utilisés comme mordants pour les colorants .
- Acétate de palladium (II) — utilisé comme catalyseur pour les réactions de couplage organique telles que la réaction de Heck.
Les acides acétiques substitués produits comprennent :
- Acide monochloroacétique (MCA), acide dichloroacétique (considéré comme un sous-produit) etacide trichloroacétique. Le MCA est utilisé dans la fabrication du colorant indigo.
- Acide bromoacétique, qui est estérifié pour produire le réactif bromoacétate d’éthyle.
- L’acide trifluoroacétique, qui est un réactif courant dans la synthèse organique.
Les quantités d’acide acétique utilisées dans ces autres applications (hormis le TPA) représentent 5 à 10 % de l’utilisation mondiale d’acide acétique. Cependant, la croissance de ces applications ne devrait pas être aussi importante que celle de la production de TPA.
Sécurité
L’acide acétique concentré est corrosif et doit donc être manipulé avec précaution, car il peut provoquer des brûlures cutanées, des lésions oculaires permanentes et une irritation des muqueuses. Ces brûlures ou cloques peuvent n’apparaître que plusieurs heures après l’exposition. Les gants en latex n’offrant aucune protection, il est conseillé de porter des gants particulièrement résistants, comme ceux en caoutchouc nitrile, lors de la manipulation de ce composé. L’acide acétique concentré peut s’enflammer difficilement en laboratoire. Il présente un risque d’inflammabilité si la température ambiante dépasse 39 °C (102 °F) et peut former des mélanges explosifs avec l’air au-dessus de cette température (limites d’explosivité : 5,4 à 16 %).
Les solutions contenant plus de 25 % d’acide acétique sont manipulées sous hotte aspirante en raison de leurs vapeurs âcres et corrosives. L’acide acétique dilué, sous forme de vinaigre, est inoffensif. En revanche, l’ingestion de solutions plus fortes est dangereuse pour la vie humaine et animale. Elle peut provoquer de graves lésions du système digestif et une modification potentiellement mortelle de l’acidité du sang .